6-OHDA损毁建立部分损伤PD模型
1.低剂量6-OHDA内侧前脑束或黑质注射
(1)操作步骤
Fisher大鼠,雄性,体重275g左右。腹腔注射水合氯醛麻醉后,按上述方法固定于脑立体定位仪上,切开皮肤,暴露前、后囟以确定注射部位。损毁内侧前脑束(MFB)者定位于前囟后4.0mm,中线旁开1.8mm,颅骨外表面下8.5mm:损毁黑质吻侧部者定位于前囟后5.0mm,中线旁开2.0mm,颅骨外表面下7.5mm。注射6-OHDA剂量4ug,注射时间为1分钟,留针5分钟,然后慢慢退针(约2分钟)。缝合皮肤后,将大鼠放口笼中。
(2)模型检测
行为学检测:术后第三周,将大鼠腹腔内注射AMPH(5mg/kg),诱发大鼠向损伤侧旋转。于第四周,再次腹腔内注射APO(0.05mg/kg),诱发大鼠向健侧旋转。用自动旋转测试仪计数每次药物注入后90分钟内大鼠旋转次数。将AMPH诱发旋转大于200圈/小时,且APO诱发旋转小于60圈/小时者,定为部分损伤大鼠模型。
2.6-OHDA纹状体内注射
(1)操作步骤
SD大鼠,雌性,体重225g左右,按上述方法麻醉,固定,暴露前囟。注射部位于左、右侧纹状体均可。定位参数以前囟和颅骨中线为参照。注射部位在前囟前1.0mm,中线旁开3.0mm,硬脑膜下4.5mm:注入6-OHDA剂量为20ug(溶解于3ul 0.9%的生理盐水中并加入0.2mg/ml的抗坏血酸)。注射时间约3分钟,留针3分钟后慢慢退出。
(2)模型的检测
旋转行为检测:术后一周,将大鼠腹腔内注射AMPH(5mg/kg)诱发大鼠旋转。计数90分钟内的旋转次数。于第三周,皮下注射APO(0.25mg/kg),诱发大鼠向健侧旋转。计数40分钟内大鼠旋转次数。AMPH诱发旋转在3圈/分钟者,可作为部分损伤PD模型。
迈步试验:选择一个1.1米长,倾斜放置的木板,木板的一端连通鼠笼。试验开始前3天,先让鼠对试验环境有所适应,并设法训练大鼠慢慢爬回到笼中。试验开始后,实验者一只手固定大鼠双后肢并轻轻上提,使其离开桌面,另一只手固定一侧前肢,让未固定的一侧前肢接触桌面。待该前肢自动移动时,开始计时。记录从开始迈步到回到鼠笼所需要的总时间。同时记录走过整个斜面的步数。然后,用斜面的长度除以步数即为步长。检测顺序为先左侧后右侧,并重复2次。
步态调整试验:研究人员用上述相同的方法固定大鼠后,向侧前方慢慢移动大鼠,使其在5秒钟内走完90 cm距离,记录大鼠所用的步数。然后再向侧后方移动大鼠,记录步数。检测顺序为先右侧后左侧。每天重复2次。正常大鼠对这种被动运动的反应是被检前爪出现一系列的调整步态,6-OHDA损伤大鼠健侧前爪这种步态调整的次数明显减少,而损伤一侧前爪往往不受影响。
熟练运用前肢的试验。在一有机玻璃制成的方盒内,放置一个有7层台阶的斜梯,在斜梯的第2-5层台阶的两侧各放10粒大鼠饲料颗粒,每粒45mg重。动物禁食2天后置于试验盒中,使其熟悉试验环境并爬梯取食。然后连续测试7天。分别记录每次测试中大鼠抓取和吃掉的饲料颗粒数。(Deniz Kirik等,1998)
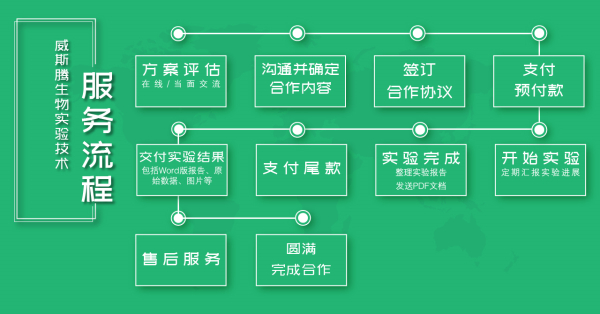
【服务流程】
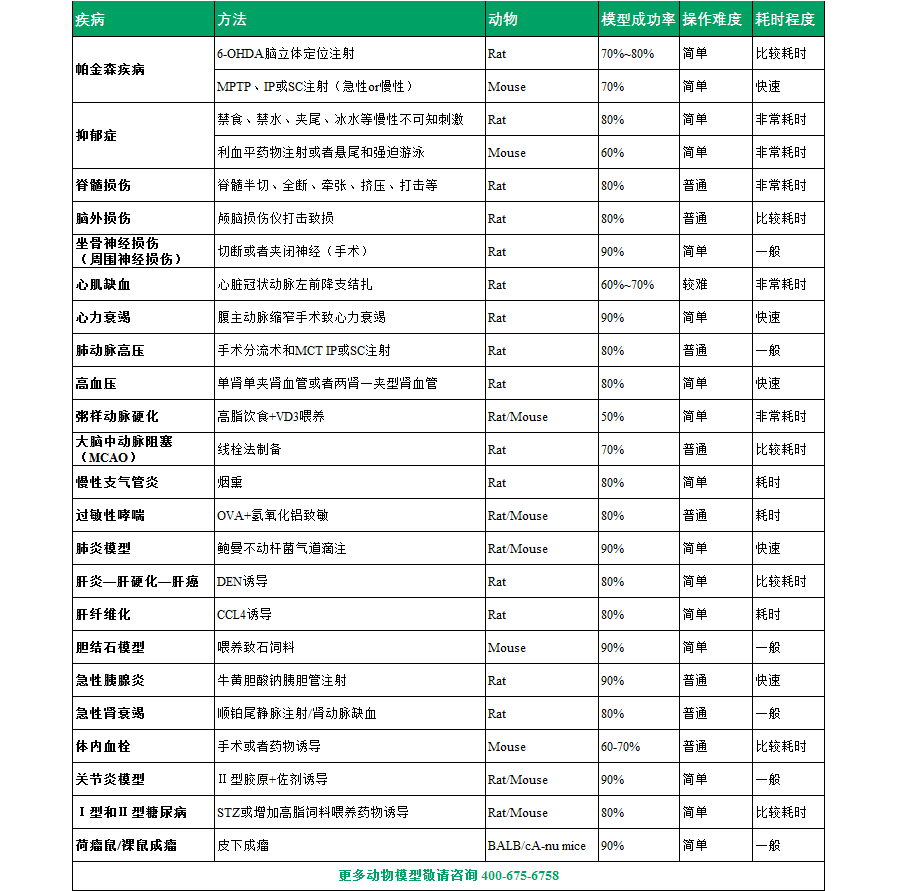
【本平台可构建的动物模型(部分)】
【本平台合作项目】
分子生物学、细胞生物学、病理染色检测、细胞敲除/敲入、模式与转基因动物、SPF动物保种、免疫学检测、影像学检测、原代培养、细胞药筛、CRISPR/Cas9基因编辑、基因芯片、高通量测序、蛋白组学、代谢组学、高通量高内涵筛选、药效学评价、药理毒理学实验、慢病毒包装与稳转株建立、siRNA与纳米载药、ChIP、Co-IP、生物信息学分析、知识产权服务!
【全国免费热线】400-675-6758
【电话】 023-65227525
【邮箱】 china-western@163.com
【官网网址】www.cqwestern.net;www.cqwestern.com
【地址】 重庆市高新区二郎创业大道高科创业园D栋2楼

